-臨床成績-
本剤は、国内での臨床試験を実施しておらず、承認の際、審査・評価された海外データを紹介します。
用量(濃度)比較試験(海外第Ⅱ相試験)1)、2) <海外データ>
| 目的 |
ペンタサⓇ注腸(1、2、4g/100mL)及びプラセボ注腸1日1回就寝前投与における用量反応性を比較検討する。 |
|---|---|
| 対象 |
軽症~中等症の活動期潰瘍性大腸炎患者287例(解析症例計287例) |
| 試験デザイン |
多施設共同(米国の18施設)、無作為化、プラセボ対照、二重盲検 |
| 試験方法 |
本剤1g、2g、4g/100mL及びプラセボ注腸を1日1回、8週間経直腸投与した。 |
| 主要評価項目 |
医師による概括評価(PGA:Physician's Global Assessment) |
| 解析計画 |
主要評価項目であるPGAはロジスティック回帰分析を用いた。 |
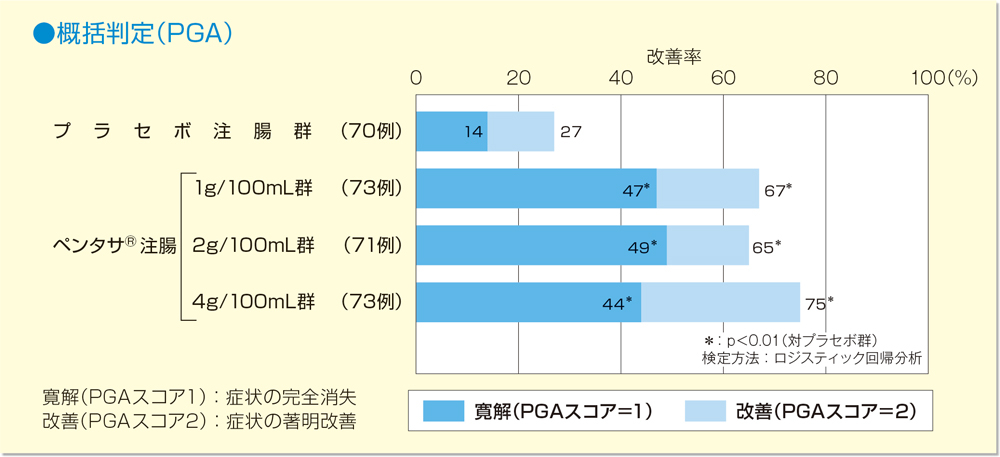
PGAにおいて改善効果を認めた患者は、プラセボ注腸群で27%、ペンタサⓇ注腸1g/100mL群では67%、2g/100mL群では65%、4g/100mL群では75%であり、いずれの用量においてもプラセボ注腸群と比較し有意に高い治療効果を示した(各群 p<0.01、ロジスティック回帰分析)。なおペンタサⓇ注腸群間での有意な差は認められなかった。
〈安全性〉
副作用は、プラセボ注腸群で70例中7例(10%)、ペンタサⓇ注腸群(1、2、4g/100mL)では217例中30例(13.8%)50件に認められた。主な副作用はペンタサⓇ注腸群では腹痛7件(3.2%)、下痢5件(2.3%)であり、プラセボ注腸群ではそれぞれ2件(2.9%)、3件(4.3%)であった。
重篤な副作用は、ペンタサⓇ注腸群(1、2、4g/100mL)で12例24件が報告され、主な重篤な副作用は腹痛4件、下痢及び直腸障害が各3例であった。死亡は認められなかった。
試験を中止した患者の割合は、プラセボ注腸群で37%、ペンタサⓇ注腸群(1、2、4g/100mL)では、それぞれ8%、11%、10%であった。
通常、成人には1日1個(メサラジンとして1g)を、直腸内注入する。なお、年齢、症状により適宜減量する。
ステロイド注腸剤との比較試験(海外第Ⅲ相試験)3) <海外データ>
| 目的 |
ペンタサⓇ注腸1g/100mLとプレドニゾロン注腸25mg/100mLの有効性及び安全性を比較検討する。 |
|---|---|
| 対象 |
軽症~中等症の活動期潰瘍性大腸炎患者123例(解析症例114例) |
| 試験デザイン |
多施設共同(デンマークの7施設)、無作為化、プレドニゾロン注腸対照、二重盲検 |
| 試験方法 |
本剤1g/100mL又はプレドニゾロン注腸25mg/100mLを1日1回就寝前に4週間経直腸投与した。(2週間時点で寛解が得られている場合は投薬終了) |
| 主要評価項目 |
臨床判定及びS状結腸鏡判定を総合した概括判定による寛解率、改善率 |
| 解析計画 |
カイ二乗検定、フィッシャーの正確確率検定、マン・ホイットニーのU検定 |
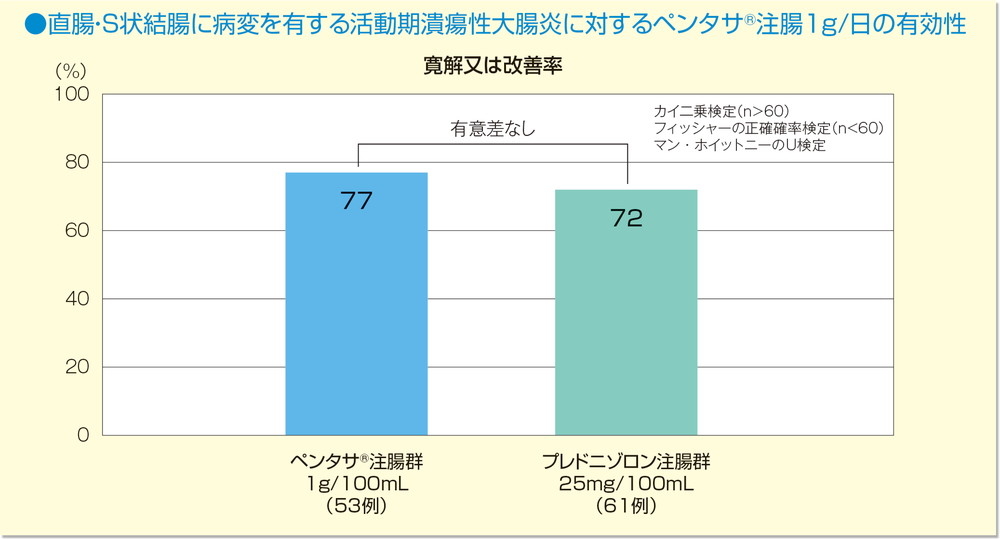
臨床判定及びS状結腸鏡判定を総合した概括判定において、寛解又は改善率はペンタサⓇ注腸群77%、プレドニゾロン注腸群72%であった。
〈安全性〉
副作用は、ペンタサⓇ注腸群では61例中13例(21.3%)、プレドニゾロン注腸群では62例中6例(9.7%)に認められた。ペンタサⓇ注腸群では嘔気・嘔吐2例、腹部膨満3例、疝痛3例、注腸保持困難2例、精神異常1例、抑うつ1例、関節硬直及び倦怠感1例、プレドニゾロン注腸群では嘔気・嘔吐2例、腹部膨満1例、精神異常2例、倦怠感1例であった。
重篤な副作用及び死亡は両群とも認められなかった。試験を中止した副作用は、ペンタサⓇ注腸群で注腸保持困難1例、抑うつ1例、関節硬直及び倦怠感1例に認められ、プレドニゾロン注腸群では認められなかった。
ペンタサⓇ注腸特定使用成績調査における副作用の発現状況一覧表
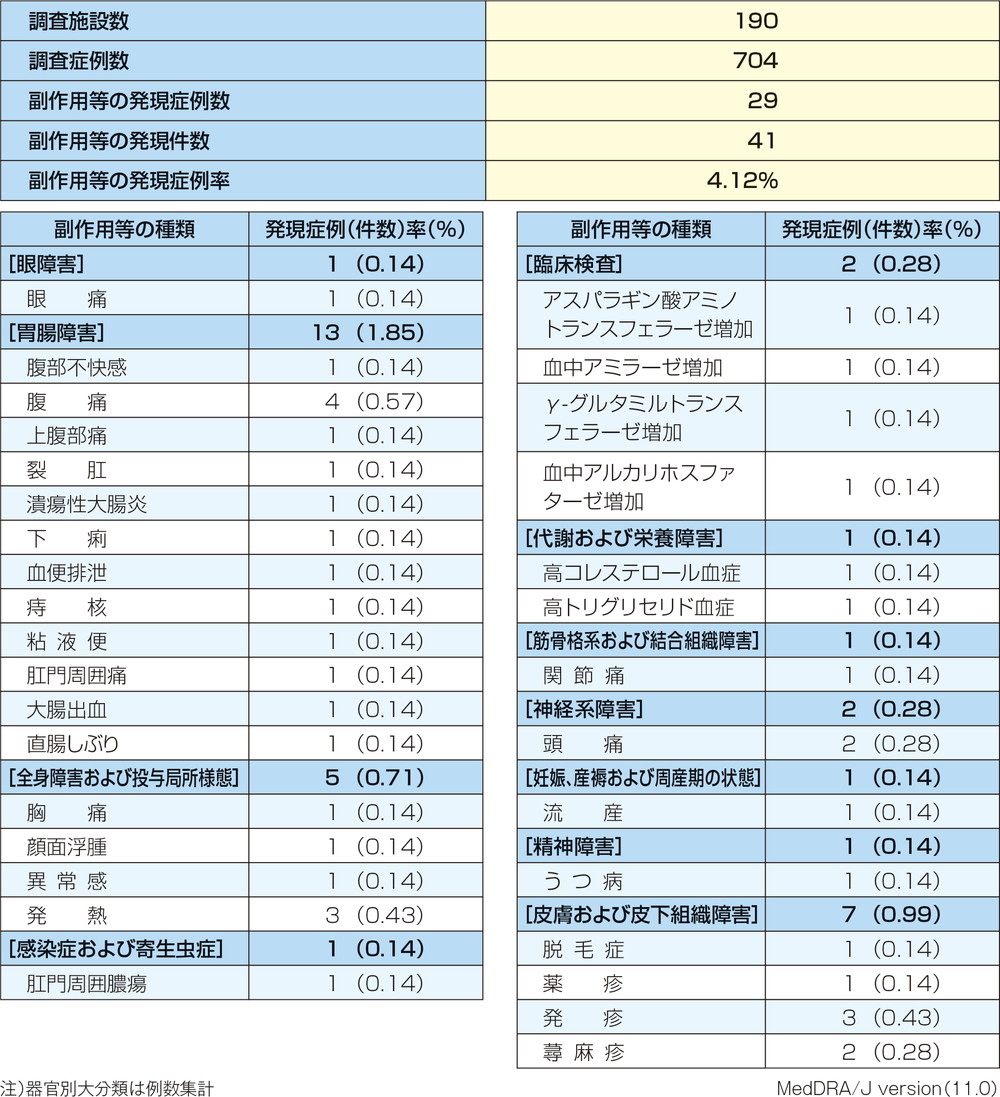
本試験ではペンタサ®注腸剤 4g/100mLを用いており、承認用量と異なりますが、承認時評価資料であり長期の安全性を評価する上で、参考になると考え紹介します。
安全性試験(海外第Ⅲ相試験)4) <海外データ>
| 目的 |
ペンタサⓇ注腸剤(4g/100mL)の長期投与における安全性を検討する。 |
|---|---|
| 対象 |
軽症~中等症の活動期及び寛解期潰瘍性大腸炎患者236例 |
| 試験デザイン |
多施設共同(米国29施設)、非盲検 |
| 試験方法 |
|
| 主要評価項目 |
安全性(有害事象、臨床検査) |
〈安全性〉
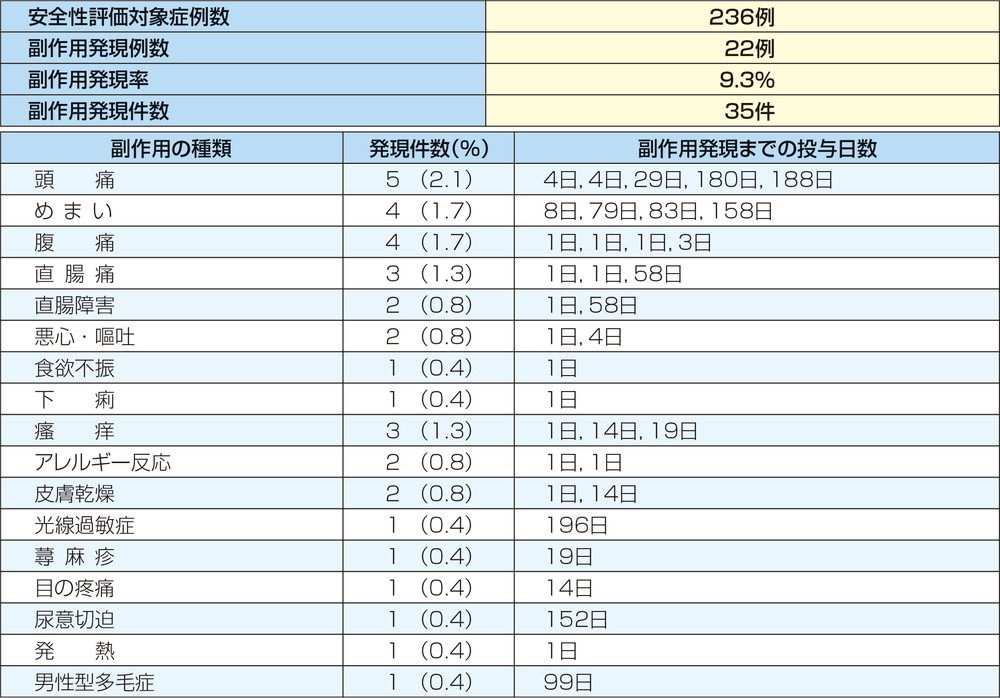
副作用は236例中22例(9.3%)35件が認められ、うち6例(2.5%)の症例が試験中止あるいは一時的な投与の中断を必要とした。主な副作用は頭痛(2.1%)、めまい(1.7%)、腹痛(1.7%)、直腸痛(1.3%)等であった。
重篤な副作用は10例17件が報告され、主な重篤な副作用は直腸痛3件、めまい、腹痛及びアレルギー反応が各2件であった。
通常、成人には1日1個(メサラジンとして1g)を、直腸内注入する。なお、年齢、症状により適宜減量する。
〈試験継続・中止〉
試験参加者236例中128例が試験終了日まで投与を継続し、残り108例は試験方法遵守違反(8%)、自由意志(9%)、効果不足(9%)、有害事象(7%)等の理由で試験を中止した。投与期間毎の試験終了又は中止症例数は、3ヵ月以内42例、3ヵ月以上6ヵ月未満46例、6ヵ月以上9ヵ月未満73例、9ヵ月以上12ヵ月未満45例、12ヵ月以上15ヵ月未満30例であった。
〈有効性〉
活動期の患者でS状結腸鏡スコア、排便回数が低下したが、寛解期の患者では85.1%の患者が当初の状態を維持した。
-
1)
Hanauer S.B.:Inflammatory Bowel Disease 1998; 4:79-83
利益相反:本研究はFerring社の資金により行われた。 - 2) 海外第Ⅱ相用量(濃度)比較試験(社内資料:承認時評価資料)
-
3)
Danish 5-ASA Group.:Dig. Dis. Sci. 1987;32(6):598-602
利益相反:本研究はFerring社の資金により行われた。 - 4) 海外第Ⅲ相長期投与試験(社内資料:承認時評価資料)
禁忌を含む注意事項等情報につきましては電子添文をご参照ください。

