池田
森田先生、食物アレルギーのアレルゲンが消化されずに吸収されるメカニズムについてご教示くださいという、かなり特殊な質問がきています。まず食物アレルギーはどのようにして起こるかわかっているのでしょうか。
森田
はい。食物アレルギーは、食物アレルゲンに感作された患者さん、つまり食物アレルゲンに対する特異的IgE抗体を保有している患者さんにおいて、それと同じ食物が摂取された場合に起きる全身性のアレルギー反応と考えられています。
アレルギー反応は、組織のマスト細胞や好塩基球に結合したアレルゲン特異的IgEが、摂取された食物アレルゲンによって分子結合されることにより、マスト細胞や好塩基球が活性化され、これらの細胞が放出するヒスタミンなどの化学伝達物質による炎症反応であると理解されています。
池田
少々難しい言葉が出たのですが、分子結合とはどんなイメージなのでしょうか。
森田
これは、アレルゲンによって2つ以上のIgE分子がくっつくという反応です。それによって膜の活性化が起きて、マスト細胞や好塩基球がヒスタミンなどのケミカルメディエーターを遊離するというシグナルが入ります。
池田
では、アレルゲン1個がIgE1個に付いても刺激は起こらないのですか。
森田
それでは何も起きないのです。2つ以上のIgEが結合されることが必須です。
池田
小さなタンパク質というか、アミノ酸ぐらいだとだめだということですね。
森田
はい。それだと、IgEを結合できないので、アレルギーを起こしえない。だから大きな分子が必要になるのですね。
池田
それをIgE架橋というのですか。
森田
架橋と呼ばれています。
池田
アレルゲンには一定の大きさが必要だというのはこの話からなのですね。
森田
はい。
池田
この質問は、こうした大きな食物アレルゲン分子がどのようなメカニズムで消化管に吸収されるのかということだと思うのですが、その前に、どうしてこのような特異的IgEが産生されるのかは、わかっているのでしょうか。
森田
すべてのアレルギーについてわかっているわけではないのですが、私たちが研究している小麦アレルギーについてはかなりわかってきています。小麦アレルギー患者さんの遺伝子解析を行ったところ、HLAクラス2の特殊なタイプが小麦アレルギーの発症と非常に高い相関があることがわかっています。
これはHLA-DPB1*020102というHLAクラス2の頻度の高いタイプで、日本人だと4人に1人が保有しています。つまり日本人の4人に1人は小麦アレルギーになる体質を持っていると考えることができます。
ただ、実際に小麦アレルギーになる方は、我々の検討では成人の場合0.2%ですので、1,000人のうち2人ということになります。だから実際に発症するのにはさらにもう一つのステップ、あるいは環境要因かもわかりませんが、それが加わってアレルギーが発症すると考えたほうがいいように思います。
池田
遺伝と環境ということですが、1,000人に2人というのはかなりの多さですね。
森田
私たちが行った島根県での住民検診での調査ですので、おそらく日本全体でもそんなには変わらないと思いますが、欧米などの人種、あるいは国によってどうかというデータはまだありません。
池田
例えば「お宅のお子さん、食物アレルギーはありますか」と尋ねたら、実際はわからないけれども、「あ、あります」みたいに言う人もいますし、そういった聴取による調査ということですね。
森田
聴取による調査をまず行い、小麦アレルギーの確認は、血清をいただいてIgEを検出するという段階も踏んでいますので、これはかなり確かなデータです。問診だけの調査ではなく血清解析をしています。
池田
特異的IgEも検出されているのですか。
森田
そうです。
池田
かなり精度の高い調査ですね。では、1,000人に2人はいるのでしょうか。
森田
そうですね。成人の小麦アレルギーの頻度です。
池田
それは大した数ですね。社会的な問題だと思いますけれども、先ほどの比較的大きなアレルゲン分子が吸収されるという研究について、先生方は長年研究しているとうかがいました。どのような研究なのでしょうか。
森田
食物アレルギーの中には、食物依存性運動誘発アナフィラキシーという特殊病型があります。この病型は、原因食物を食べただけではアレルギー症状は誘発されないのですが、原因食物を食べた後に運動する、あるいは食べる前にアスピリンなどのNSAIDsを服用した場合に、アレルギー症状が誘発されるという病型です。
患者さんの大部分は小麦が原因となっています。通常、小麦タンパク質というのは、食事として摂取されると、消化管内で消化酵素によってアミノ酸レベルまで分解されますので、アミノ酸の状態となって消化管上皮から吸収されて、体内では栄養素として利用されます。
そのように食物アレルゲンがアミノ酸まで分解されて吸収されると、マスト細胞や好塩基球に結合した複数のIgE分子を架橋することができませんので、アレルギー症状は起こらないのです。
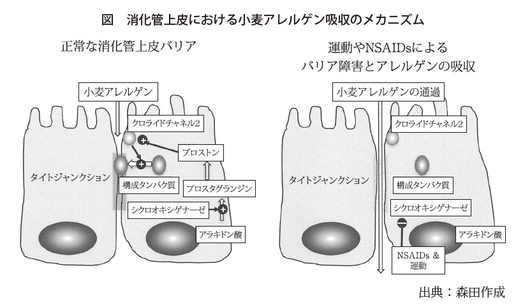
そこで私たちは小麦による食物依存性運動誘発アナフィラキシーで、運動やNSAIDsによってアレルギー反応が誘発されるメカニズムとして、小麦製品を摂取した際に、未消化な、大きな分子が吸収されて血中に移行するということを明らかにしました(図)。
こうした大きな分子が吸収されるという現象は、健常者にも普通に見られます。けれども、健常者には小麦アレルギーの特異的IgEがありませんので、アレルギー症状は示さないのです。
さらに私たちはNSAIDsや運動で誘発されるメカニズムを解析しました。NSAIDsによる消化管障害を予防するミソプロストールという薬剤があります。これをあらかじめ服用しておくと、NSAIDsによる血中の大きな小麦分子の上昇が抑えられることを明らかにしています。
同じように、ミソプロストールを服用しておくと、運動によって血中の大きな小麦アレルゲン分子が上昇するのも抑制されます。
池田
運動やNSAIDsで消化管の上皮の障害が起こって、比較的大きな分子が吸収されるということですが、運動やNSAIDsがなぜ一定の大きさのアレルゲン分子の吸収を促進するのかというメカニズムはわかっているのでしょうか。
森田
はい。消化管上皮細胞は、通常はタイトジャンクションと呼ばれる細胞接着構造でくっついています。そうして、上皮を構成しているのですが、その状態では、大きな分子が消化管上皮を通過することは制限されています。しかし、消化管内では消化酵素や食物、糞便など、いろいろなものが通りますので、消化管上皮のタイトジャンクションは絶えず障害されていると推測されます。
しかし障害されたタイトジャンクションは通常、速やかに修復されます。消化管のタイトジャンクションの修復には、上皮細胞の膜にあるクロライドチャネル2という分子が重要な役割を担っていることがわかっています(図)。クロライドチャネル2の活性維持に、アラキドン酸カスケード、つまりアラキドン酸から生成されるプロスタグランジンやプロストンなどの分子が関与しているのです。
その際にアスピリンなどのNSAIDsを服用しますと、消化管上皮が障害を受けます。これは、タイトジャンクションを修復する機能が作用しないために、消化管上皮が障害されて胃腸障害を起こすと理解されます。
このようなことから私たちは、大きなアレルゲン分子が消化管から吸収されるメカニズムとして、NSAIDsの服用や、運動による消化管の疎血から消化管上皮細胞のアラキドン酸カスケードがうまく働かずにタイトジャンクションの障害が速やかに修復されず、大きなアレルゲン分子が消化管上皮を通過してしまうという仮説を提唱しています。
池田
なるほど。簡単に言うと、消化管のバリア障害ということになるのでしょうか。
森田
そうですね。消化管のバリア障害が起きるために大きな分子が吸収されてしまいます。その要因として、NSAIDsなどの消化管上皮を障害する作用のある薬物、あるいは運動があるのです。運動すると、血流が筋肉に取られますので、消化管への血流が低下して、消化管上皮のタイトジャンクションの修復が障害される。タイトジャンクションの修復にはアラキドン酸カスケードがかかわっていて、疎血によってアラキドン酸カスケードがうまく働かないとプロスタグランジンやプロストン欠乏を起こし、タイトジャンクションが修復されない。そのため大きなアレルゲン分子が消化管上皮を通過してしまうということが起きるのだろうと予測されます。
池田
興味深いですね。これは少し特殊といいますか、食物依存性運動誘発アナフィラキシーでのお話になるのですが、一方で運動やNSAIDsにあまり関係のない食物アレルギーの患者さんにおいて、こういう一定の大きさのアレルゲン分子が吸収されるメカニズムはどう推定されているのでしょうか。
森田
まず、食物アレルギーが圧倒的に多いのは乳幼児です。乳幼児の場合は、実は食物アレルギーの発症に至るアレルゲンは経皮吸収されることがわかってきています。アトピー性皮膚炎の患者さんに食物アレルギーが多いのは、食物アレルギーがあるためにアトピー性皮膚炎が発症するのではなく、アトピー性皮膚炎になると、皮膚のバリアが障害されるために食物アレルゲンが経皮的に微量ながら吸収されて、感作が起きるからなのです。そのため食物アレルギーが多いということがわかってきています。
だから、乳幼児、小児に見られる食物アレルギーと、成人になって発症する食物アレルギーは発症するメカニズムが大きく違うというわけです。
池田
子どもさんたちの消化管においてもやはりある程度の大きさのアレルゲンが吸収されているわけですが、吸収されるメカニズムはどう推定されているのでしょうか。
森田
おそらく、乳幼児の場合は消化管が未熟でバリアが弱いために、容易に消化管上皮から大きなアレルゲン分子が吸収されてしまうのでしょう。学童期以降では、消化管上皮が成熟してきますので、大きなアレルゲン分子は吸収されなくなり、運動するとか、NSAIDsなどの消化管障害を起こす薬物を一緒に飲むとか、そういった場合に大きなアレルゲン分子が吸収される。つまり、運動誘発されるようなタイプに変わってくるのではないかと思います。
池田
皮膚においては、アトピー性皮膚炎も年齢とともにアウトグローという現象がありますが、食物アレルギーのアウトグローも消化管の発達というか、成熟に伴って消えていくという考えなのでしょうか。
森田
そういうメカニズムが背景にあると思います。
池田
どうもありがとうございました。